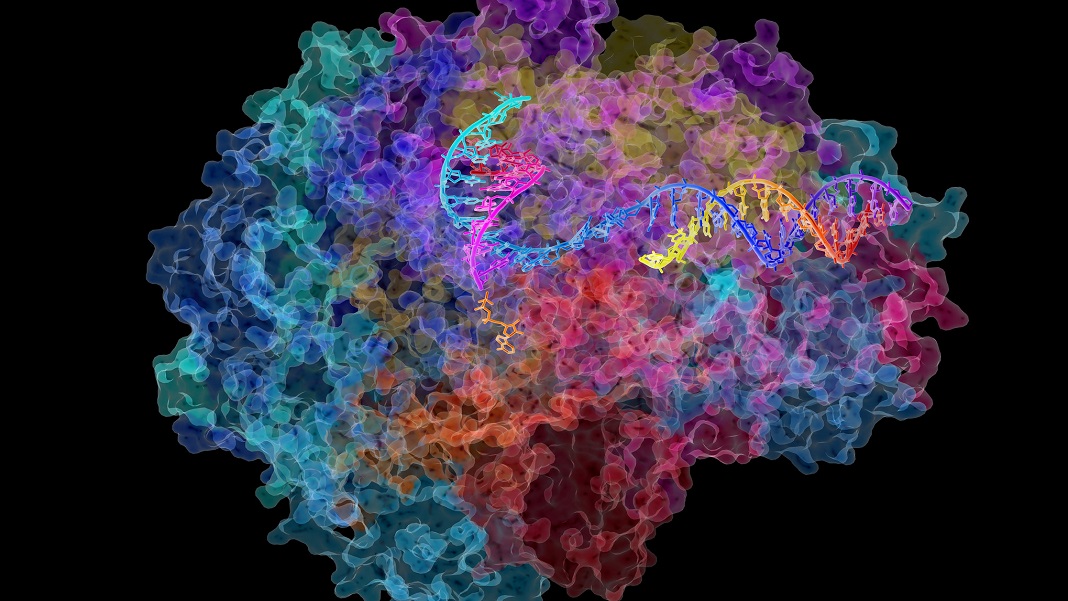
A maquinaria molecular de nossos corpos se deteriora com a idade.
O DNA acumula mutações. Suas extremidades protetoras se erodem. As mitocôndrias, a fábrica de energia da célula, vacilam e quebram. O sistema imunológico fica descontrolado. A reserva de células-tronco diminui, enquanto algumas células maduras entram em um estado de zumbi, expelindo produtos químicos tóxicos em seu ambiente.
A imagem parece terrível, mas nem tudo são más notícias. O envelhecimento é um quebra-cabeça complicado. Ao encontrar peças individuais, os cientistas podem montar uma imagem completa de como e por que envelhecemos – e projetar novas maneiras de evitar os sintomas relacionados à idade.
Já houve algum sucesso. Senolíticos—drogas que matam células zumbis—já estão em ensaios clínicos. reprogramação parcial, que apaga a identidade de uma célula e a reverte para um estado semelhante ao de uma célula-tronco, está ganhando força como um tratamento alternativo promissor e é um dos investimentos de longevidade mais quentes no Vale do Silício.
Um novo estudo in Natureza procurou outra peça para o quebra-cabeça do envelhecimento. Em cinco espécies em toda a escala evolucionária – vermes, moscas, camundongos, ratos e humanos – a equipe aprimorou um processo molecular crítico que alimenta cada célula dentro do corpo e se degrada com a idade.
O processo, chamado de transcrição, é o primeiro passo para transformar nosso material genético em proteínas. Aqui, as letras do DNA são retrabalhadas em um “mensageiro” chamado RNA, que então transporta as informações para outras partes da célula para produzir proteínas.
Os cientistas há muito suspeitam que a transcrição pode dar errado com o envelhecimento, mas o novo estudo oferece a prova de que isso não acontece - com uma reviravolta. Em todas as cinco espécies testadas, à medida que o organismo envelheceu, o processo foi surpreendentemente acelerado. Mas, como tentar digitar mais rápido com os olhos vendados, as taxas de erro também dispararam.
Há uma correção. Usando duas intervenções conhecidas por prolongar a vida útil, a equipe conseguiu desacelerar a transcrição em várias espécies, incluindo camundongos. Mutações genéticas que reverteram a transcrição desleixada também prolongaram a vida útil de vermes e moscas da fruta e aumentaram a capacidade das células humanas de se dividir e crescer.
A nova marca do envelhecimento dificilmente está pronta para testes em humanos. Mas “abre uma nova área realmente fundamental para a compreensão de como e por que envelhecemos”, dito Dr. Lindsay Wu em UNSW Sydney, que não esteve envolvido no estudo.
O Editor Genético
Transformar nosso projeto genético em proteínas é um processo de duas etapas.
Primeiro, as quatro letras do DNA – A, T, C e G – são transcritas em RNA. Também composto de quatro letras, o RNA são basicamente notas moleculares que podem passar pelo espaço confinado do DNA para entregar mensagens à fábrica de proteínas da célula. Lá, o RNA é traduzido para a linguagem das proteínas.
A primeira etapa – transformar DNA em RNA – é mais difícil do que parece. Para economizar espaço, o DNA é firmemente enrolado em torno de um grupo de proteínas chamadas histonas, como o bacon em torno de oito talos de aspargos. Isso efetivamente “esconde” a informação genética, impossibilitando a leitura da célula.
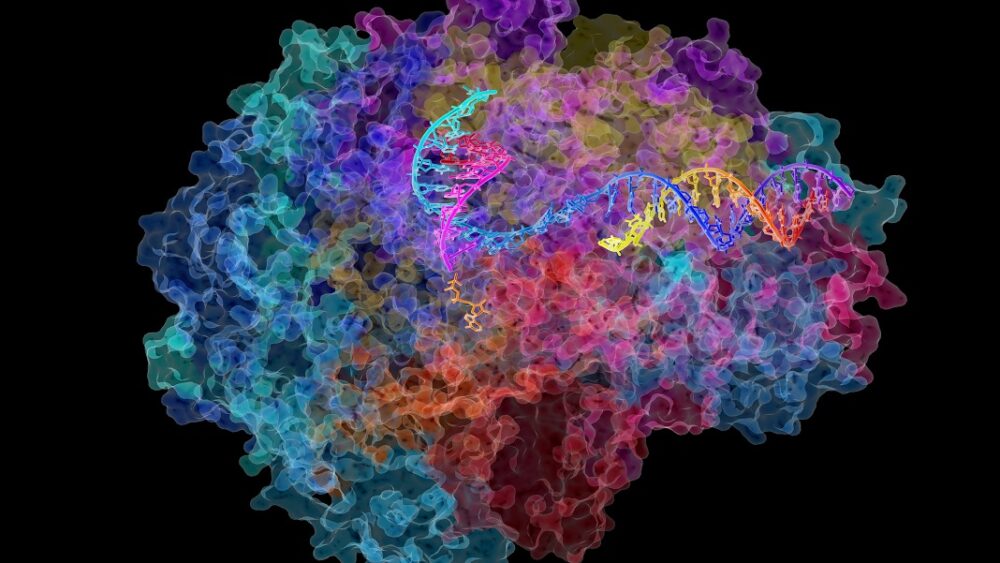
É preciso uma vila inteira de ajudantes de proteínas para desenrolar o DNA e prepará-lo para a transcrição. Mas a estrela é Pol II (RNA polimerase II), um multicomplexo gigante que se move ao longo de uma fita de DNA ajudando-a a se transformar em uma versão inicial de RNA, apropriadamente chamada de pré-RNA.
Como uma frase prolixa, o pré-RNA é então copiado em sequências mais contundentes para a construção de proteínas, um processo chamado splicing. O Pol II supervisiona todo o processo, certificando-se de que centenas de milhares de RNAs sejam produzidos com perfeição.
No entanto, à medida que envelhecemos, o processo se degrada. Ninguém descobriu o porquê.
O novo estudo perguntou: por que não focar na estrela do programa de transcrição?
Espécie Abrangente
Decifrar marcas de envelhecimento vem com um obstáculo: uma pista potencial pode ser relevante apenas para uma espécie.
O novo estudo abordou o problema de frente, examinando cinco espécies. Usando uma técnica chamada sequenciamento de RNA, eles capturaram a velocidade do Pol II ao rolar o DNA de vermes, moscas da fruta, camundongos, ratos e células humanas em diferentes idades. As amostras humanas variaram de 21 a 70 anos de idade, juntamente com duas linhagens de células "imortais" cultivadas.
Para uma visão ainda mais abrangente, a equipe testou amostras de vários órgãos, incluindo cérebro, fígado, rins e sangue.
Os resultados voltaram como uma surpresa. Embora todas as espécies tivessem sua própria “assinatura de velocidade” do Pol II, a tendência era a mesma: o Poll II acelerava entre as espécies com a idade em todos os tecidos examinados. O gene ou tecido exato não importava. A mudança relacionada à idade cobriu cerca de 200 genes diferentes em várias espécies. Em vez de uma mudança local, a aceleração do Pol II parecia ser um marcador universal de envelhecimento.
Com a velocidade, no entanto, vieram os erros. O splicing - que edita pré-RNAs - requer que a velocidade Pol II esteja em uma zona Goldilocks. Aumentar a velocidade aumenta o risco de traduções ruins, o que em estudos anteriores “foi associado à idade avançada e à redução da expectativa de vida”, explicaram os autores.
“O aumento da velocidade do Pol II pode levar a mais erros de transcrição porque a capacidade de revisão do Pol II é desafiada”, disseram eles.
Voltando o relógio
Se Pol II em overdrive contribui para o envelhecimento, podemos retardá-lo - e, por sua vez, combater o envelhecimento?
Em um teste, a equipe utilizou dois tratamentos bem conhecidos para retardar o envelhecimento: inibir a sinalização de insulina e restrição calórica. Em vermes, moscas e camundongos, a interrupção genética da via de detecção de insulina diminuiu o ritmo da Pol II. Colocar camundongos em uma dieta no início da idade adulta e na meia-idade - mas não na velhice - também freou o Pol II.
Outro teste concentrou-se na questão final: a aceleração do Pol II leva ao envelhecimento? Aqui, a equipe rastreou uma horda de vermes geneticamente modificados e moscas da fruta que abrigam mutações que reduzem sua velocidade Pol II. Em comparação com os não mutantes, ambas as linhagens modificadas prolongaram sua expectativa de vida em 10 a 20 por cento.
Quando a equipe usou CRISPR-Cas9 para reverter as mutações Pol II em vermes, no entanto, sua vida útil encurtou e combinou com os pares de tipo selvagem. Parece que Pol II é uma causa de envelhecimento, explicaram os autores.
Por quê?
Indo mais fundo no mecanismo de transcrição, a equipe encontrou uma resposta. Lembre-se: o DNA é envolto em feixes de espargos com bacon, conhecidos cientificamente como nucleossomos. Ao comparar as células da veia umbilical humana e as células do pulmão, a equipe descobriu que, à medida que as células envelhecem, os feixes lentamente se desenrolam e se desfazem. Isso torna muito mais fácil para Pol II deslizar por uma fita de DNA, por sua vez, provocando um aumento na velocidade de transcrição.
Testando ainda mais sua teoria, a equipe inseriu geneticamente dois tipos de proteínas histonas – a parte do aspargo do feixe de nucleossomos – para formar mais nucleossomos em células humanas em placas de Petri. Isso, por sua vez, criou lombadas adicionais para o Pol II e o tornou mais lento.
Funcionou. Células com proteínas histonas adicionais tiveram menos chance de se tornarem células senescentes zumbis. Nas moscas-das-frutas, um modelo popular para pesquisa de longevidade, o ajuste genético deu a elas um aumento notável na expectativa de vida.
Embora ainda seja muito cedo, os resultados são uma ótima notícia para uma nova classe de medicamentos antienvelhecimento. Pol II tem sido amplamente pesquisado na terapia do câncer, com vários medicamentos já testados e aprovados, proporcionando a chance de reaproveitar os medicamentos para pesquisa de longevidade.
“Juntos, os dados apresentados aqui revelam um mecanismo molecular que contribui para o envelhecimento e serve como um meio para avaliar a fidelidade do maquinário celular durante o envelhecimento e a doença”, disse a equipe.
Crédito de imagem: David Bushnell, Ken Westover e Roger Kornberg, Stanford University/NIH Galeria de imagens
- Conteúdo com tecnologia de SEO e distribuição de relações públicas. Seja amplificado hoje.
- Platoblockchain. Inteligência Metaverso Web3. Conhecimento Ampliado. Acesse aqui.
- Cunhando o Futuro com Adryenn Ashley. Acesse aqui.
- Fonte: https://singularityhub.com/2023/04/18/this-longevity-study-across-5-species-found-a-new-pathway-to-reverse-aging/
- :tem
- :é
- $UP
- 10
- 70
- a
- habilidade
- Capaz
- Acumular
- em
- Adicional
- avançado
- Idade
- Envelhecendo
- Todos os Produtos
- juntamente
- já
- alternativa
- Apesar
- e
- Outro
- responder
- à parte
- aprovou
- SOMOS
- ÁREA
- por aí
- AS
- Avaliando
- associado
- At
- autores
- em caminho duplo
- Mau
- Basicamente
- BE
- Porque
- tornando-se
- sido
- Bloquear
- sangue
- corpo
- impulsionar
- Impulsionado
- aumenta
- Cérebro
- Break
- quebra
- Prédio
- by
- chamado
- CAN
- Câncer
- terapia de câncer
- Capacidade
- Causar
- Células
- desafiado
- chance
- alterar
- classe
- Clínico
- combater
- comparado
- comparando
- complicado
- compreensivo
- contribuindo
- coberto
- criado
- crédito
- crítico
- dados,
- mais profunda
- entregar
- Dieta
- diferente
- terrível
- Doença
- dna
- down
- distância
- Drogas
- durante
- Cedo
- mais fácil
- efetivamente
- termina
- energia
- engenheiro
- Entrar
- Todo
- Meio Ambiente
- erro
- erros
- Mesmo
- Cada
- Examinando
- explicado
- estender
- fábrica
- Cair
- mais rápido
- fidelidade
- figurado
- descoberta
- Primeiro nome
- Fixar
- Escolha
- formulário
- encontrado
- quatro
- da
- cheio
- fundamental
- ganhando
- gigante
- Go
- vai
- ótimo
- Grupo
- Cresça:
- Ter
- ajuda
- SUA PARTICIPAÇÃO FAZ A DIFERENÇA
- mais quente
- Como funciona o dobrador de carta de canal
- Contudo
- HTTPS
- humano
- Centenas
- Identidade
- imagem
- Sistema imunológico
- impossível
- in
- Incluindo
- aumentando
- Individual
- INFORMAÇÕES
- Investimentos
- envolvido
- IT
- jpg
- Matar
- conhecido
- língua
- conduzir
- tempo de vida
- como
- linhas
- Fígado
- local
- longo
- longevidade
- maquinaria
- moldadas
- fazer
- FAZ
- Fazendo
- marcador
- correspondido
- material
- Importância
- maduro
- Posso..
- significa
- mecanismo
- mensagens
- Coração
- As mitocôndrias
- modelo
- molecular
- mais
- movimentos
- múltiplo
- Natureza
- Novo
- notícias
- notável
- Notas
- romance
- of
- Oferece
- Velho
- on
- ONE
- abre
- Outros
- A Nossa
- próprio
- Paz
- parte
- peças
- passado
- por cento
- fotografia
- peça
- peças
- platão
- Inteligência de Dados Platão
- PlatãoData
- pol
- piscina
- Popular
- potencial
- potencialmente
- atribuições
- Preparar
- apresentado
- anterior
- Problema
- processo
- promissor
- prova
- protetor
- Proteína
- Proteínas
- fornecendo
- Colocar
- quebra-cabeça
- questão
- RAT
- Preços
- em vez
- Leia
- pronto
- reduzir
- relevante
- lembrar
- pesquisa
- Reservar
- restrição
- Resultados
- revelar
- reverso
- Risco
- RNA
- Enrolado
- grosseiramente
- Dito
- mesmo
- cientistas
- parecia
- parece
- sentença
- sequenciamento
- servir
- mostrar
- Silício
- Vale do Silício
- solteiro
- slide
- lento
- Lentamente
- alguns
- Espaço
- velocidade
- velocidades
- Estrela
- Estado
- Steam
- haste
- Células-tronco
- Passo
- Ainda
- Estirpes
- caso
- Estudo
- tropeçando
- sucesso
- surpresa
- sydney
- Sintomas
- .
- toma
- Batido
- Profissionais
- teste
- ensaio
- que
- A
- as informações
- deles
- Eles
- milhares
- hermeticamente
- para
- Transformar
- tratamento
- Trend
- desencadeando
- VIRAR
- Passando
- torção
- tipos
- final
- compreensão
- Universal
- Descontraia
- usava
- Vale
- versão
- Ver
- Aldeia
- maneiras
- bem conhecido
- qual
- enquanto
- QUEM
- inteiro
- de
- trabalhou
- verme
- vermes
- Envolvido
- wu
- anos
- zefirnet