Rick Young este un profesor de biologie la MIT care studiază ARN-ul care este transcris din partea genomului care nu codifică proteine, cunoscut sub numele de ADN necodificator. Această parte a genomului a fost denumită odată „ADN nedorit”, ceea ce vă oferă o idee despre ceea ce mulți au considerat valoarea ei. Oamenii de știință au fost surprinși să descopere că reprezintă 98% din genomul uman, ceea ce a declanșat o căutare pentru a-i găsi funcțiile.
În această conversație, Rick Young discută cu Hanne Winarsky de la Bio Eats World și partener general a16z Jorge Conde, care conduce investițiile la intersecția dintre biologie, informatică și inginerie. Înainte de a se alătura a16z, Conde a fost Chief Strategy Officer la Syros Pharmaceuticals și a co-fondat compania de interpretare a genomicei Knome.
Conversația acoperă ceea ce am învățat despre acel 98% din genomul pe care l-am crezut că este gunoi. Se pare că are diverse funcții, de la ascunderea dovezilor infecțiilor virale străvechi până la a face fiecare față să arate unică. Ei discută, de asemenea, rolul său masiv, dar încă puțin înțeles în boală, și modul în care studierea ADN-ului nedorit a condus la descoperirea unui comutator de pornire/oprire a genei la care nimeni nu se aștepta.
Notă: această conversație a fost inițial publicată ca episod din Bio Eats World. Puteți asculta acel episod aici.
HANNE WINARSKY: Suntem aici pentru a vorbi astăzi despre ceea ce se numește ADN nedorit. Putem începe doar cu o definiție simplă?
RICK YOUNG: Acesta este un termen vechi de aproximativ jumătate de secol. Oamenii de știință știau despre porțiuni ale genomului care nu codifică proteine și ei teoretizat că asta era gunoi. Știam că unele dintre ele erau doar rămășițele vechilor invazii virale ale genomului. Dar acea expresie, ADN nedorit, ne-a bântuit.
HANNE: Deci, care este termenul pe care încerci să-l folosești în schimb? Materia întunecată a ADN-ului despre care înțelegem mai mult în fiecare zi?
RICK: ADN necodificator.
HANNE: De ce s-au gândit la asta ca la un detritus? Ați menționat că unele dintre ele erau fragmente de virus vechi rămase. Dar de ce nu a fost doar un mister de la început?
RICK: Pentru că de-a lungul istoriei biologice, a existat această dezbatere asupra a ceea ce era materialul genetic și, inițial, sa crezut că era proteine. Dar odată ce a devenit clar că proteinele sunt mașinile și ADN-ul era modelul pentru mașini, oamenii s-au ocupat cu mașinile, deoarece defectele mașinilor cauzează boli. Dar apoi s-a dovedit că doar 2% din genom codifică aminoacizii pentru proteine. Marea majoritate, 98%, nu. Și în 2000, când oamenii de știință de la Proiectul Genomului Uman prezentat secvența genomului uman, acele date au confirmat că 98% din cele 3.2 miliarde de baze ale noastre nu codifică proteine.
Fiecare genă are acea capacitate remarcabilă de a lua bucăți și bucăți de segmente de proteină pe care le va codifica și de a o aranja astfel încât produsul pe care îl obțineți într-o celulă să funcționeze puțin mai rapid sau într-o altă celulă să intre într-o altă celulă. compartiment pentru a face o altă treabă.
JORGE CONDE: Care au fost estimările inițiale ale câte gene ar fi codificate în acele 3.2 miliarde de perechi de baze?
RICK: Ne-am hotărât cu aproximativ 100,000. Am presupus că, cu cât suntem mai complexi, cu atât genomul este mai mare și numărul de gene este mai mare. A fost un pic de șoc când ne-am dat seama că noi și insectele avem aproximativ același număr de gene.
JORGE: Mai puține gene decât am anticipat care codifică pentru ceea ce considerăm a fi un organism incredibil de complex, nu?
HANNE: Este un pic de șoc.
Același cod sursă, programe diferite
JORGE: Un lucru pe care l-am învățat cu toții în liceu este că codurile ADN pentru ARN, codurile ARN pentru aminoacizi și aminoacizii ne dau proteine, nu? Aceasta este dogma centrală a biologiei moderne.
RICK: Da. Unul dintre marile motive pentru care oamenii s-au grăbit să atribuie titlul de „ADN nedorit” aceluiași 98% din genom care nu codifică proteine este pentru că se credea, în mare parte, că scopul comercial al genomului era să facă proteine.
JORGE: Deci, când au început geneticienii să înțeleagă că ADN-ul nedorit ar putea fi mai mult decât gunoi?
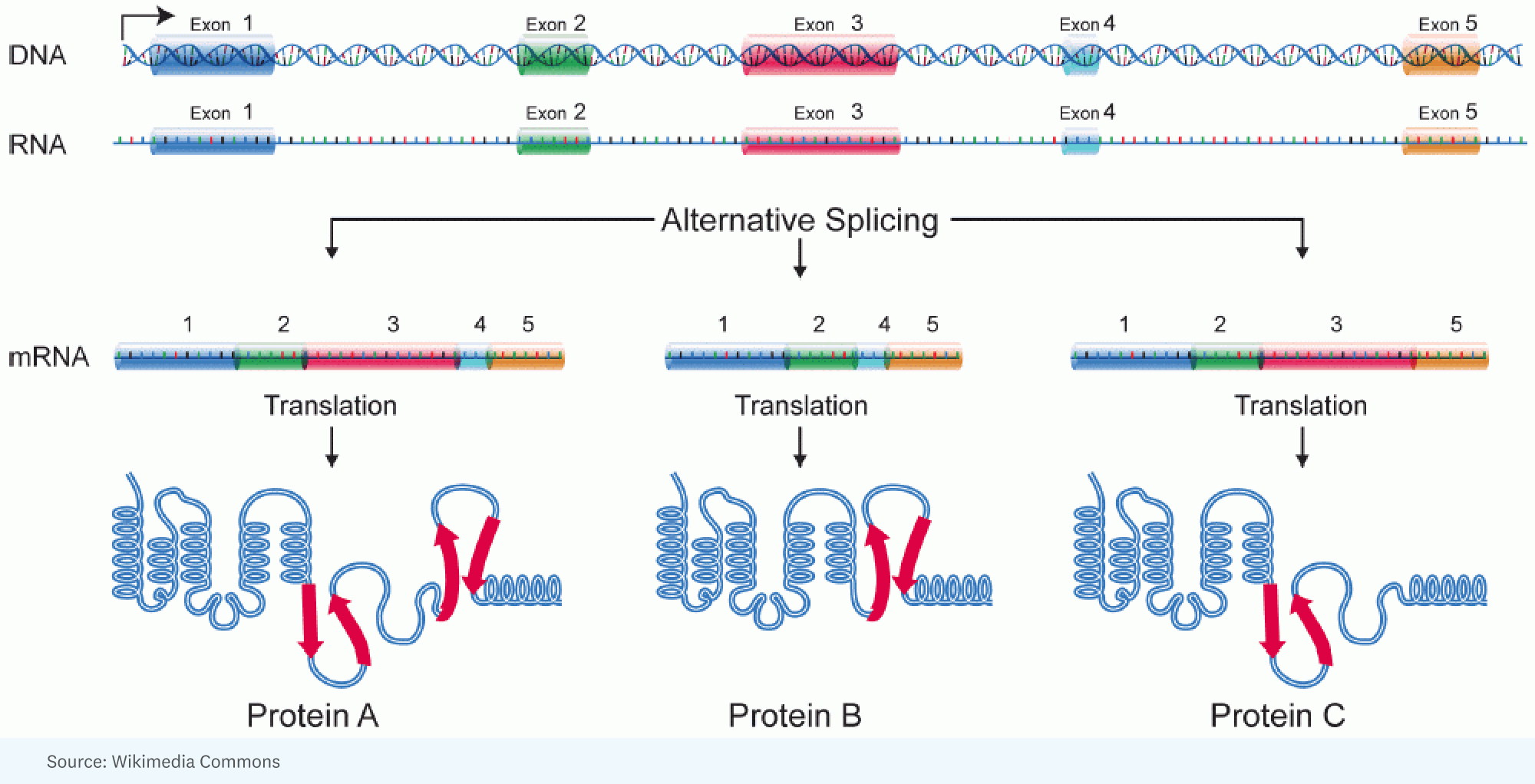
RICK: [A început cu] conștientizarea că ai putea explica complexitatea suplimentară a ființelor umane față de insecte printr-o cantitate enormă de îmbinare alternativă. Acolo aveți, pentru o singură genă, un ARN mare care este produs, dar este îmbinat diferit într-o celulă față de altă celulă. Cu alte cuvinte, diferite porțiuni ale genei ajung în molecula de ARN care va specifica proteina. Deci proteina este puțin diferită.
HANNE: Sună ca un caleidoscop puțin cu lumina care îl lovește diferit, obții culori diferite, unghiuri diferite.
RICK: Ei bine, și asta e o analogie interesantă. Cred că o analogie mai bună este atunci când ai aceste Lego și poți face o mașină, dar o poți face în atât de multe moduri diferite, atât de multe structuri, culori diferite. Fiecare genă are acea capacitate remarcabilă de a lua bucăți și bucăți de segmente de proteină pe care le va codifica și de a o aranja astfel încât produsul pe care îl obțineți într-o celulă să funcționeze puțin mai rapid sau într-o altă celulă să intre într-o altă celulă. compartiment pentru a face o altă treabă.
JORGE: Fiecare celulă dintr-un anumit om are aproximativ același genom. Cu toate acestea, același genom dă naștere unei game incredibil de diverse de tipuri de celule diferite. Și astfel, în măsura în care vom face o analogie, fiecare tip de celulă rulează un program diferit din același cod sursă.
RICK: Așa este.
Funcțiile celor 98%
JORGE: Nu trebuie să fii un expert ca să te uiți la diferite tipuri de celule și să vezi cât de variate pot fi, nu? Un neuron arată foarte, foarte, foarte diferit și funcționează foarte, foarte diferit decât, să zicem, o celulă musculară. Ce determină programul, programul genetic pe care o celulă alege să-l ruleze? Ce face o celulă musculară o celulă musculară și ce face un neuron un neuron?
RICK: Așa că am început cu ADN-ul produce ARN și [ARN] produce proteine. Asta e dogma centrală. Dar acum aproximativ o jumătate de secol, oamenii de știință au început să argumenteze că, de fapt, ARN-ul a început să creeze diferite tipuri de funcții pe cont propriu. Și se dovedește că ARN-ul are de fapt o parte din activitate în primele etape de dezvoltare.
Când spermatozoidul întâlnește ovulul, este ARN-ul mamei pe care ea îl pune în acel ovul. Există molecule de ARN care fac acest lucru. Se pare că antibioticele pe care le folosim în mod obișnuit se leagă de ARN. Deci ARN-ul are niște roluri destul de importante acolo. Asta a schimbat modul în care oamenii gândesc. Apoi, când am început să ne gândim la ADN-ul nedorit, aceasta este partea ADN-ului care nu codifică proteine. Ei bine, dacă lumea se bazează pe ARN și nu pe proteine, cel puțin la început? Și acum înțelegem că o parte uriașă din ceea ce numim ADN nedorit, sau ceea ce obișnuiam să numim ADN nedorit, nu este gunoi. Este extrem de funcțional. Și cea mai mare parte produce ARN.
Deci, scopul tău în programarea oricărei celule este să folosești doar acel set specific de secvențe care vor regla fiecare dintre acel set comun de gene la nivelul dorit. . . .Problema noastră este că nu știm de fapt programul.
HANNE: Uau. Poți să faci un pic de întindere a pământului unde ne aflăm în înțelegerea părții necodificatoare a ADN-ului? Știi, care este înțelegerea noastră actuală a tuturor posibilităților diferite de acolo?
RICK: Doar 2% din genomul nostru codifică aceste secvențe de aminoacizi care intră în proteine. Deci, ce este în registrul contabil al contabilului nostru pentru ceea ce face restul?
Aproximativ jumătate din genomul nostru este ceea ce numim heterocromatină. De acolo obțineți produsele vechilor invazii virale. Retrovirusurile antice au invadat, apoi au fost transformate în ADN și au fost inserate în genom. Deci, acesta este de fapt un mijloc pe care l-am avut de-a lungul istoriei noastre evolutive pentru a ascunde secvențe cu care nu vrem să ne confruntăm. Și rămâne tăcut în genomul nostru, cu o excepție importantă.
Cealaltă jumătate este locul unde sunt toate genele active care codifică proteinele și unde sunt toate genele active necodificatoare. Deci, ce face? Are o listă lungă de funcții de reglementare, dar o voi simplifica în trei.
Una dintre funcțiile sale este întreținerea cromozomilor. Deci, acestea sunt locurile în care are loc replicarea ADN-ului. Ele sunt locurile din genomul nostru care sunt responsabile pentru plierea acestuia, deoarece este un polimer lung de 2 metri. Trebuie să fie pliat într-un nucleu cu diametrul de doi microni.
A doua regiune de reglementare este toate aceste lucruri care sunt responsabile pentru reglarea genelor. Probabil că mult mai mult din genom specifică caracteristicile de reglementare pentru expresia genelor decât specifică genele în sine. Și asta pentru că fiecare celulă folosește o regiune de reglare diferită pentru fiecare genă.
HANNE: Este atât de interesant, mie mi se pare un pic aproape ca și cum ar fi dulapul cu rafturile pe el cu lucruri pe care trebuie să le punem în dulap pentru puțin timp, apoi mai este și dulapul de infrastructură.
De ce este important să ne concentrăm atât de mult pe asta? Pentru că acolo apar peste 75% din toate variațiile genetice asociate bolii.
RICK: Da. Practic, ceea ce aveți este un set comun de gene în fiecare celulă, atât codificante, cât și noncodante. Și aveți elemente, aveți secvențe reale care funcționează numai în anumite tipuri de celule. Deci, scopul tău în programarea oricărei celule este să folosești doar acel set specific de secvențe care vor regla fiecare dintre acel set comun de gene la nivelul dorit. Deci cânți la un instrument muzical uimitor de 20,000 de gene care codifică proteine și aproximativ același număr de gene necodificatoare. Faceți asta prin secvențe specifice. Problema noastră este că nu știm de fapt programul.
Tachinarea programului de reglementare
HANNE: Deci cum începi să-ți dai seama? Care sunt indicii pe care le urmați atunci când începeți să încercați să înțelegeți acest program?
RICK: Sugestiile sunt că regiunile de reglare pentru fiecare genă dintr-o celulă se afișează. Îți spun ei. Și poți folosi diverse tehnologiiSunt care vă spun foarte repede pe întregul genom, într-un anumit tip de celulă, să spunem într-un neuron motor, care sunt toate regiunile de reglare care se află în acea celulă. Puteți chiar să vedeți unde este setat reostatul pentru fiecare dintre acele gene. Acolo este locul în care secvențierea rapidă ne-a oferit aceste capacități de a deduce simultan toate elementele active pentru gene, atât codificante, cât și necodante în genomul unui anumit tip de celulă.
Problema noastră în acest moment este că trebuie să faceți acest lucru aproape un tip de celulă la un moment dat și avem multe, multe sute de tipuri de celule. Uneori este greu să vezi o anumită celulă fără a contamina cu alte celule, deoarece toate țesuturile noastre sunt într-adevăr combinații de mai multe tipuri de celule.
JORGE: Merită să argumentăm prin analogie dacă am spune că, având în vedere că fiecare celulă are întregul genom, fiecare celulă are întregul cântec, anumite tipuri de celule aleg să cânte simfonii specifice, iar mecanismul care ajută la reglarea genomului este în esență conducătorul Orchestra? Acea mașinărie este dirijorul care determină ce melodii să cânte, ce note să lovească, la ce volum să le lovească, la ce tempo, etc. Este aceasta o analogie rezonabilă pentru înțelegerea funcției de reglare a genomului?
RICK: În sensul că este ușor să vezi care ar fi rezultatul. Dar ceea ce este mai provocator este cine scrie toate notele? Cine este compozitorul care a pus toate acele note acolo și a înțeles totul bine? Compozitorul se dovedește a fi, pentru majoritatea celulelor și a genelor noastre, aceste molecule proteice numite factori de transcripție, a căror sarcină este să se lege de elementele de reglare ale genelor și să le ofere un cadru de reostat.
Acum, există o încrețitură interesantă în asta, deoarece în acele locuri unde se leagă acei factori de transcripție, îi numim un potențiator. La acele site-uri de amplificare, există întotdeauna un ARN care se face din acel site unde sunt legați. Abia recent am ajuns să înțelegem că ARN-ul joacă un rol important în reglare. Doar pentru a amplifica asta: felul în care iPhone-ul tău îți recunoaște fața se datorează faptului că amplificatorii care controlează genele structurii faciale craniene variază la fiecare ființă umană.
Ceea ce ai acum aici este acest triumvirat. Aveți secvența ADN. Este recunoscut în mod specific de molecula care o compun, factorul de transcripție, dar are nevoie de această a treia bucată, această moleculă de ARN. Deci, ADN-ul, ARN-ul și proteina lucrează împreună în acele regiuni de reglementare. Și de ce este important să ne concentrăm atât de mult pe asta? Pentru că acolo apar peste 75% din toate variațiile genetice asociate bolii.
HANNE: Nu pentru a deveni prea tocilar din punct de vedere muzical, dar aproape că sună ca un acord, nu? Structura de trei note joacă toate împreună pentru a crea ceva mai mare.
RICK: Așa este.
Programatorii
JORGE: Una dintre cele mai avansate domenii ale biologiei este capacitatea noastră tot mai mare de a încerca să înțelegem unele dintre legile care guvernează modul în care sunt determinate programele celulare, cum este determinată soarta celulelor. Pentru mine, unul dintre salturile fascinante înainte în înțelegerea noastră a venit din munca pe care a făcut-o Yamanaka, pentru care a primit premiul Premiul Nobel, demonstrând că puteți reprograma tipurile de celule doar prin expunerea celulelor la o mână foarte mică de factori de transcripție specifici.
HANNE: Poți să descrii de ce exact a fost o astfel de descoperire pentru domeniu?
RICK: Am avut un mic rol în filmul acela. Se pare că, deși acesta este un număr foarte mare, un număr mic de factori de transcripție pot identifica toate elementele de reglementare care sunt esențiale pentru identitatea acelei celule. Și Yamanaka ne-a dovedit acest lucru, arătând că doar patru dintre acești factori ar putea fi folosiți pentru a programa orice celulă umană sau orice celulă masculină în echivalentul unei celule stem embrionare.
O modalitate de a te gândi la asta este, dacă cântecul este prea rău, organismul nu trăiește. Dar dacă nu e puțin, crești, devii adult și apoi dobândești toate aceste diverse boli pe măsură ce îmbătrânim.
JORGE: Și asta e uimitor, nu? Pentru că asta ar sugera că sistemul este cumva proiectat în cazul în care o complexitate incredibilă este extrasă din ceea ce sună a simplitate. Patru factori de transcripție care determină toată cascada complexă de evenimente care guvernează diferite tipuri de celule.
Unele dintre lucrările pe care le-ați făcut au demonstrat că acești factori de transcripție maeștri creează, în esență, echivalentul circuitelor care controlează genele care sunt necesare pentru ca o celulă să își stabilească și să-și mențină starea. Puteți descrie ce înțelegeți prin circuite de control al genelor?
RICK: Există două elemente interesante în circuitele de control al genelor. Unul este că, atunci când un regulator principal găsește acești amplificatori și provoacă exprimarea genelor sale țintă, aceasta este o parte a circuitului, aceasta este rezultatul. Celălalt element care este atât de cool este că factorii de transcripție maeștri își reglează și propria exprimare. Deci există o buclă de feedback. De exemplu, ai avea o diagramă electrică în care maeștrii își controlează propria expresie din propriile lor gene și apoi se leagă și controlează expresia unui set țintă de gene.
JORGE: E destul de sălbatic. Este aproape ca o referință circulară, în care factorii de transcripție sunt proteine, acea proteină este făcută din ADN, codificat într-o genă. Factorii de transcripție fac parte din mecanismul care ajută la exprimarea în transcrierea genelor. Prin urmare, spuneți că factorii de transcripție – proteina – ajută la reglarea expresiei genelor care produc factorii de transcripție.
HANNE: Da. Există o imagine mentală a acestei întregi simfonii a tuturor acestor mici celule, știi, cântând toate aceste texturi diferite.
Genomul reglator și boala
HANNE: Ce se schimbă când începem să înțelegem cum funcționează toate acestea? Ce putem face cu aceste cunoștințe?
RICK: Aceste locuri în care acești factori de transcripție maeștri conduc identitatea fiecărei celule sunt cele mai multe dintre variațiile umane care provoacă boala. Peste 75% din variațiile asociate bolii au loc în aceste elemente amplificatoare care conduc genele cheie.
JORGE: Bine. Deci e sălbatic, nu? Când ne gândim la mutațiile care cauzează sau contribuie la boală, în mod normal ne gândim la o mutație care are loc în interiorul unei gene care afectează proteina, rupe cumva proteina și care dă naștere la boală.
HANNE: Corect.
JORGE: Dar vrei să spui că, în 75% din cazuri, mutația respectivă are loc de fapt în afara genelor, se întâmplă în această regiune necodificatoare a genomului. Dacă gena este cântecul, nu înseamnă că melodia este redată greșit, ci că s-ar putea cânta prea tare, sau prea moale, sau prea încet, sau prea repede, dar asta provoacă multe boli.
RICK: De fapt, o modalitate de a te gândi la asta este, dacă cântecul este prea rău, organismul nu trăiește. Dar dacă nu e puțin, crești, devii adult și apoi dobândești toate aceste diverse boli pe măsură ce îmbătrânim.
Pentru prima dată, avem toate aceste modele pentru modul în care configurați aparatul și îl faceți să funcționeze.
JORGE: Nu facem versiunea greșită a genei, ci obținem doza greșită a genei. Prea mult sau prea puțin.
RICK: Este corect. Cum găsești terapii care se ocupă de asta? Cum reglați selectiv în sus sau în jos gena? În principiu, putem face asta în multe feluri și putem face asta cu terapia genică. Putem face asta cu editarea genelor CRISPR. Dar cel mai important lucru pe care cred că l-am descoperit în ultimii ani este că fiecare dintre aceste elemente de reglare a genelor are un ARN. ARN-ul este funcțional. Este un reostat care ajută la reglarea ieșirii acelei gene. Acum există multe moduri în care poți ARN-urile medicamentului. Noi avem ASO-uri (oligonucleotide antisens), cum ar fi Spinraza pentru atrofia musculară spinală. Avem interferență ARN. Avem câteva medicamente noi cu molecule mici la orizont. Dacă te-ai putea gândi la modalități de a programa acum un medicament, un ARN sintetic, pentru a regla ARN-ul regulator, ARN-ul de reglare, ai principalul mod de a regla orice genă în orice celulă în care celula respectivă poate avea acces la acel medicament.
HANNE: Deci nu este doar o înțelegere complet diferită a modului în care apare boala. Dar este o cu totul altă înțelegere a modului în care am putea trata boala.
RICK: Exact. În principiu, avem acum o modalitate programabilă de a dezvolta un medicament care reglează orice genă de interes. În acest moment, oamenii programează pur și simplu molecule de ARN sintetic pentru a produce un vaccin pentru această pandemie. Unul care este un rezultat la fel de bun pe cât te-ai putea aștepta vreodată pentru un vaccin.
JORGE: Când ne gândim la aplicațiile lui tehnologie în biologie, de obicei încercăm să facem unul dintre cele două lucruri. Fie încercăm să interogăm biologia foarte profund și să o înțelegem, crescând nivelurile sale de complexitate, fie încercăm să intervenim. Suntem din ce în ce mai capabili să interogăm biologia la un nivel foarte, foarte profund, astfel încât să înțelegem legile care guvernează sau regulile prin modul în care sunt reglementate celulele. Și avem asta, avem instrumente din ce în ce mai sofisticate, ca acestea modalităţi programabile ale medicinei, unde putem viza ARN, foarte, foarte specific. Acesta va fi oarecum acest ciclu virtuos între capacitatea noastră de a interoga biologia și apoi de a interveni în moduri din ce în ce mai sofisticate. Și cred că acesta este unul dintre cele mai interesante aspecte ale locului în care ne aflăm astăzi în acest domeniu.
RICK: Sunt de acord cu tine. Acum dezvoltăm o înțelegere atât de profundă a multiplelor straturi de complexitate, încât putem veni cu ipoteze terapeutice pe care nu le-am văzut până acum. Le putem face cu o viteză pe care nu am conceput-o niciodată cu doar câțiva ani în urmă. Acea distanță temporală dintre o descoperire de bază și terapia care a intrat în oameni în urmă cu 10 ani a fost în medie de 14 ani. Acum, este de imaginat să ne gândim la dezvoltarea unei ipoteze terapeutice bazate pe știința de bază și a unei terapii care ajunge la un pacient în nouă luni. Suntem văzând că cu acest nou vaccin.
HANNE: Deci, schimbând nu doar modul în care înțelegem apariția bolii, cum o tratăm, ci și modul în care facem știința în sine și apoi cât de repede se poate întâmpla știința și se poate transforma în realitate clinică pentru pacienți.
ARN ca agent de compartimentare
RICK: Exact. Dar acum este cireașa de pe tort pentru că, în mod clasic, ne-am gândit la farmacologie în două moduri. Unul a fost efectul drogului asupra individului. Celălalt a fost efectul individului asupra drogului. Și în acest ultim segment, ești îngrijorat de distribuția medicamentului, la ce țesuturi merge, la ce țesuturi nu este disponibil. Pentru că doar presupunem că, odată ce un medicament intră într-o celulă, acesta difuzează prin celulă și își găsește ținta. Avem compartimente legate de membrană, despre care știm de un secol.
JORGE: Care a fost întotdeauna întrebarea privind permeabilitatea celulei, nu? Poate traversa membrana?
RICK: Da. Poate traversa o membrană și intră sau nu în nucleu? Dar am ajuns să înțelegem abia în ultimul deceniu că există și multe corpuri nemembranare în celule numite condensate biomoleculare deoarece se crede că unul dintre motivele pentru care aceste corpuri se formează este că se condensează la fel cum apa se condensează într-o picătură de rouă. Dar ceea ce a fost atât de profund despre această înțelegere este că aceste condensate compartimentează proteine, ADN, ARN pentru funcții specifice. Și acum am ajuns să înțelegem că puteți separa cele 5 până la 10 miliarde de proteine și molecule de ARN dintr-o celulă în diferite compartimente în care funcționează împreună cu prietenii lor.
HANNE: Huh.
JORGE: Părăsim tărâmul biologiei și intrăm în tărâmul fizicii?
RICK: Am făcut exact asta pentru că se crede că separarea fazelor este forța motrice. Acesta este un fenomen fizic descris de matematică.
HANNE: Uau.
RICK: Acum, am aflat că cele mai eficiente medicamente chimioterapeutice sunt concentrare în interiorul compartimentelor în care locuiesc țintele lor. Ei se concentrează de 600 de ori peste restul celulei, așa că au activitate la țintă asupra oncogenelor, care este de 600 de ori mai mare decât ne așteptam. Acest lucru nu numai că ne spune că există noi perspective care sunt importante în descoperirea și dezvoltarea de medicamente pentru viitor, dar ne face să dorim să înțelegem mai bine ce fac acești condensați.
Iată ce vreau să spun prin cireașa de pe tort. Ceea ce am ajuns să realizăm este că aceste compartimente de condensat care funcționează celula în moduri atât de importante sunt reglate de ARN. Formarea lor poate fi stimulată de ARN. Dacă produceți prea mult ARN, aduceți reostatul la 11, acesta va dizolva un condens. Deci, brusc, ne dăm seama că producția de ARN la orice loc din interiorul unei celule poate regla funcția oricărui lucru prin îmbunătățirea sau dizolvarea acelor condens în care are loc această funcție. Și asta cred că este profund, deoarece este o altă modalitate prin care un ARN programabil, o moleculă de ARN sintetic, ar putea fi folosit pentru a regla funcția unei celule care a devenit disfuncțională. Pentru prima dată, avem toate aceste modele pentru modul în care configurați aparatul și îl faceți să funcționeze.
HANNE: Un alt buton de apelat.
RICK: Dar atunci cum îl oprești? Se pare că atunci când faci acel ARN lung, este doar un șir mare de sarcini negative și dizolvă condensatul și oprește gena. Așa se reglează genele. Ajustați condensatul cu un ARN, apoi îl închideți cu produsul ARN care este făcut când gena este complet transcrisă.
HANNE: Super tare. Deci un comutator de oprire și pornire, într-adevăr.
RICK: Este un comutator oprit/pornit pe care nimeni nu l-a anticipat. Și înseamnă, încă o dată, dacă aveți un medicament programabil, aveți o nouă modalitate de a viza funcțiile celulare care sunt disfuncționale, o nouă soluție pentru o problemă terapeutică.
JORGE: ADN-ul nedorit al unui bărbat este mașina sofisticată de reglare a genomului altuia.
HANNE: Sau al oricărui bărbat.
Postat pe 15 iulie 2022
Tehnologie, inovație și viitor, așa cum au spus cei care o construiesc.
- Andreessen Horowitz
- Bio & Știință
- Bitcoin
- blockchain
- respectarea blockchain-ului
- conferință blockchain
- coinbase
- coingenius
- Consens
- conferință cripto
- cripto miniere
- cryptocurrency
- descentralizată
- DEFI
- Active digitale
- ethereum
- masina de învățare
- jeton non-fungibil
- Plato
- platoul ai
- Informații despre date Platon
- Platoblockchain
- PlatoData
- platogaming
- Poligon
- dovada mizei
- W3
- zephyrnet